大塚製薬株式会社
ユーシービージャパン株式会社
「イーケプラ®」、新規抗てんかん薬として
単剤療法の効能・効果を申請
- 「イーケプラ®」は、部分発作に対する他の抗てんかん薬との併用薬として日本で2010年に発売し、現在抗てんかん薬の売り上げ市場シェアが最も高い薬剤※1。この度、従来の併用療法に加え単剤で使用できるように申請。海外ブランド名「Keppra®」は1999年に米国で発売以来100以上の国・地域で広く使用され、全世界で600万人の患者さんに使用経験がある。国際抗てんかん連盟は単剤での使用について有効性のエビデンスが高い薬剤と位置づけており※2、欧州では既に単剤療法の第一選択薬としても使用されている
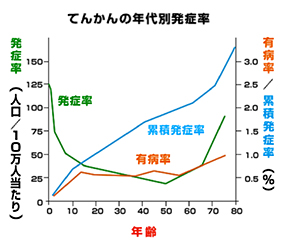
- てんかんは、慢性の脳疾患で人種・性別に関係なく約1%の頻度で発症し、特に小児期と高齢期で発症率が高く、国内てんかん患者数は約100万人と推定。てんかん治療の中心は、薬物療法であり、適切な診断に基づき単剤による治療を開始すると7割の患者さんが発作のない生活を送れるが、従来の抗てんかん薬は副作用や薬物相互作用などの問題があり、これらの問題の少ない新規抗てんかん薬※3による単剤での薬物療法が望まれている
- 厚生労働省の「医療上の必要性の高い未承認薬・適応外薬検討会議」において、「部分発作に対する単剤療法」の適応取得に向けた開発要望が関連学会より提出された。検討会議にて医療上の必要性が高いとの評価を得て2012年4月に開発要請があり、これを受けて試験を実施し、申請に至った
大塚製薬株式会社(本社:東京都、代表取締役社長:岩本太郎、以下「大塚製薬」)とユーシービージャパン株式会社(本社:東京都、代表取締役社長:ジョエル・ピーターソン、以下「ユーシービージャパン」) は、国内で共同開発・販売を行う「イーケプラ®錠250mg、同錠500mg、同ドライシロップ50% (一般名:レベチラセタム)」について、てんかん患者の「部分発作に対する単剤療法(二次性全般化発作を含む)」の効能・効果で一部変更承認申請を行いました。
てんかんは、「てんかん発作」と呼ばれる発作を繰り返し起こす大脳の慢性疾患です。脳内の神経細胞がいっせいに過剰に興奮し、突然強い電流を受けることで意識がなくなったり、手足がけいれんしたりするなどの「てんかん発作」が起こります。
- ※1 JPM2013年1月~12月を元に算出 ©2014IMSヘルス 無断転載禁止
- ※2 ILAE(国際抗てんかん連盟)スペシャルレポート、Epilepsia, 54(3):551-563, 2013に掲載
- ※3 新規抗てんかん薬:日本において2006年以降に発売したイーケプラを含む抗てんかん薬
てんかんは、乳幼児から高齢者まで幅広い年齢で発症する病気で、国や地域、性別や人種による発症率の違いはなく、有病率は約1%です。日本では約100万人のてんかん患者さんがいると言われており、適切な診断と薬物治療により70%以上の患者さんはてんかん発作のない生活を送ることができます。てんかん治療は、患者さんによっては小児期から長期にわたり薬剤を服用することになるため、症状に合わせた適切な診断や薬の効果を評価し、眠気、ふらつき、認知障害、皮膚症状などの副作用を考慮した、より適正な薬剤の単剤療法が望まれています。こうした背景から、日本てんかん学会や日本小児神経学会は、「部分発作に対する単剤療法」の適応取得に向けた開発要望を厚生労働省の「医療上の必要性の高い未承認薬・適応外薬検討会議」に提出しました。当検討委員会より医療上の必要性が高いとの評価を得て2012年4月に開発要請があり、これを受けて試験を実施し、この度の申請に至りました。
今回の申請により、将来的に「イーケプラ®」が更に広く利用されることで、てんかんの治療の発展につながることを期待するとともに、大塚製薬とユーシービージャパンは引き続きてんかん治療をはじめとする中枢神経疾患治療への貢献を目指していきます。
日本におけるイーケプラの開発・申請・承認状況

参考
「イーケプラ®」について
「イーケプラ®」は、1980年代初期にユーシービー社(ベルギー)で発見された中枢作用物質で、従来の抗てんかん薬と異なる作用機序を有する抗てんかん薬です。
海外では「Keppra®」のブランド名で1999年に米国、続いて2000年に欧州で発売され、全世界で600万人の使用経験がある抗てんかん薬です。日本では、ユーシービージャパンと大塚製薬が提携し「イーケプラ®」の共同開発・販売を2010年9月から成人てんかん患者の部分発作に対する併用療法で開始しました。2013年5月に小児用量が追加承認、6月に「イーケプラ®ドライシロップ50%」が承認され8月に発売しました。また同年6月に手術などで経口服薬できない患者さんのために注射剤を申請しました。全般発作に対しても、現在フェーズⅢ試験を実施中です。2014年2月現在、「成人てんかん患者の部分発作に対する併用療法」の適応では、欧米をはじめ100以上の国・地域で承認され、「小児てんかん患者の部分発作に対する併用療法」の適応でも欧州をはじめ80以上の国・地域で承認されており小児に対しても広く使用されています。
なお欧米では、成人部分発作だけでなく、ミオクロニー発作及び強直間代発作に対する併用療法や小児部分発作に対する併用療法についても追加承認されました。また欧州でも、成人てんかん患者の部分発作に対する単剤療法としても承認されています。
会社概要
ユーシービージャパン株式会社

ユーシービーグループ(![]() www.ucb.com)は、ベルギーのブリュッセルに本社を置くグローバルバイオファーマ企業です。中枢神経系、免疫領域等の重篤な疾患に特化した革新的な医薬品及びバイオテック製品の研究、開発、販売を行っています。従業員は世界でおよそ8,700名おり、約40カ国の国々で活動を行っています。2013年の売上は34億ユーロです。UCB はユーロネクストに上場しています(シンボル:UCB)。
www.ucb.com)は、ベルギーのブリュッセルに本社を置くグローバルバイオファーマ企業です。中枢神経系、免疫領域等の重篤な疾患に特化した革新的な医薬品及びバイオテック製品の研究、開発、販売を行っています。従業員は世界でおよそ8,700名おり、約40カ国の国々で活動を行っています。2013年の売上は34億ユーロです。UCB はユーロネクストに上場しています(シンボル:UCB)。






