ヒトアクアポリン2 ELISAキット
はじめに
アクアポリン2(AQP2)は300前後のアミノ酸から成る比較的小さな膜蛋白で腎臓の集合管で尿濃縮に関わっており、水分子のみを通す水チャネルであり体内水分量調節を担っています。体内が脱水になるとバソプレシン刺激を受けてAQP2は細胞内から細胞表面に移動し、原尿から水のみを再吸収し尿を濃縮します。AQP2の遺伝子異常が起こると重篤な脱水となる腎性尿崩症をきたすことが知られています。
キットの特徴
- リコンビナント・ヒトアクアポリン2を用いて作製した抗体による酵素免疫測定法(ELISA法)です。
- 尿中のアクアポリン2(AQP2)を特異的に精度良く測定することが可能です。
- ※本キットは研究用試薬であり、疾病の診断若しくはその補助の目的で使用することはできません。
キット構成
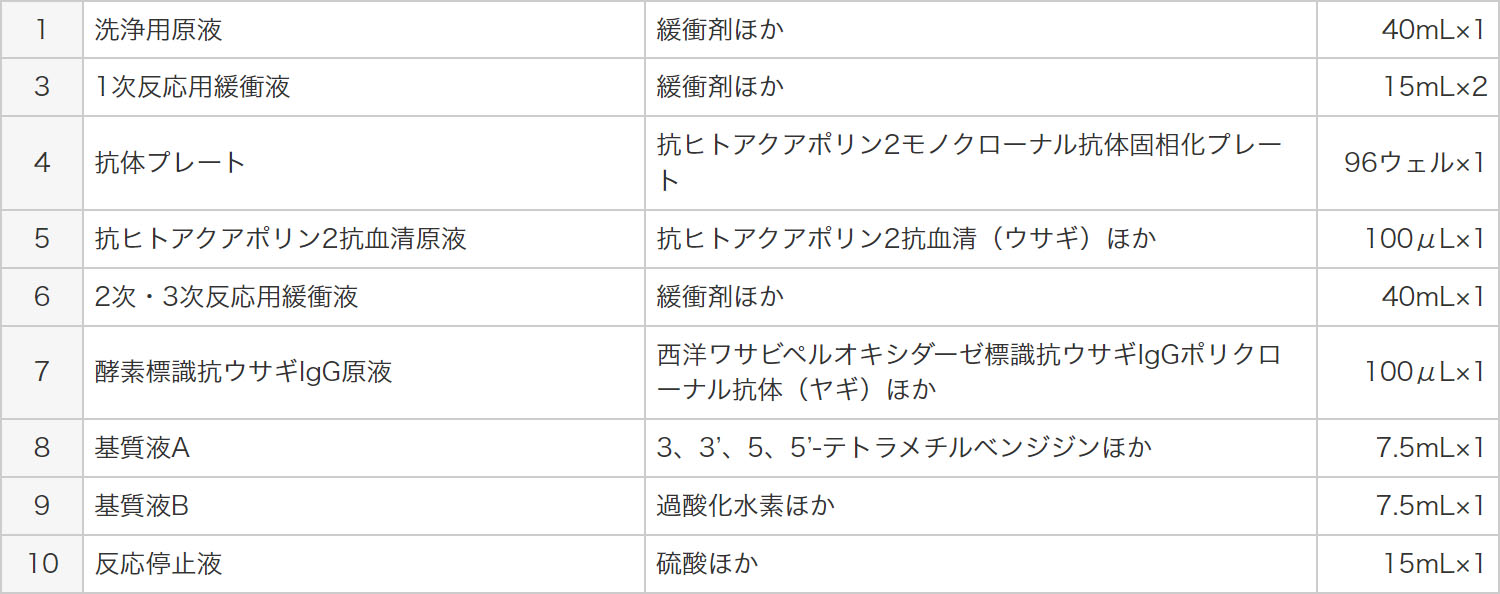

- 1必要器具、機器等
- 1メスシリンダー
- 2メスピペット
- 3マイクロピペット及びチップ
- 4プレートシェイカー
- 5プレートウォッシャー
- 6インキュベーター
- 7ペーパータオル
- 8プレートリーダー(測定波長:450nm)
- 9マイクロチューブ等(容量1.5mL以上の密閉可能な容器)
- 2試薬の調製法・保存法
- 1洗浄液
洗浄用原液全量(40mL)に精製水を960mLの割合で混和し調製する。洗浄用原液に結晶が析出している場合は、加温して溶解後に調製します。 - 2標準液
標準液(600ng/mL)20μLを1次反応用緩衝液380μLで20倍希釈し、30.0ng/mL標準液とします。30.0ng/mL標準液を2倍段階希釈して、15.0ng/mL、7.50ng/mL、3.75ng/mL、1.88ng/mL、0.94ng/mL、0.47ng/mLの濃度の標準液を調製します。なお0ng/mL標準液は1次反応用緩衝液を使用します。標準液の希釈方法を表1に示します。表1 標準液の希釈方法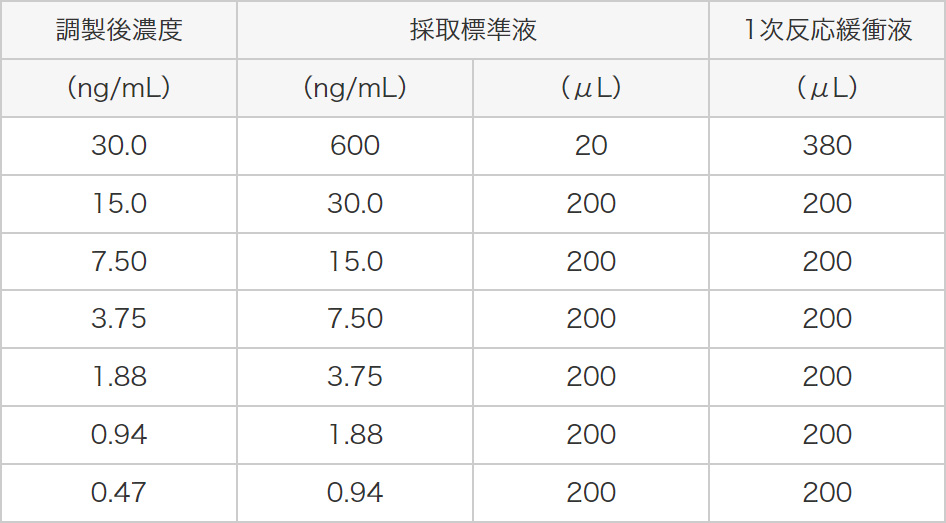
- 3抗ヒトアクアポリン2抗血清希釈液(201倍希釈)
2次・3次反応用緩衝液12mLに抗ヒトアクアポリン2抗血清原液を60μLの割合で混和し、必要量調製します。第2反応の直前に調製します。 - 4酵素標識抗ウサギIgG希釈液(201倍希釈)
2次・3次反応用緩衝液12mLに酵素標識抗ウサギIgG原液を60μLの割合で混和し、必要量調製します。第3反応の直前に調製します。 - 5基質液
基質液A6mLに基質液Bを6mLの割合で混和し、必要量調製します。発色反応の直前に調製し、速やかに使用します。
- ※測定用尿検体は、前処理が必要です。前処理方法は、使用説明書をご参照ください。
- 1洗浄液
- 3測定操作法
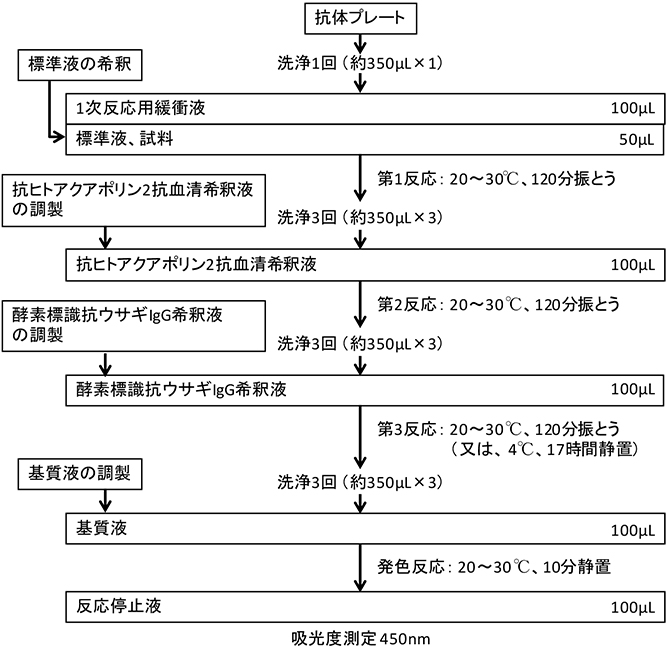
1.感度試験
標準液0ng/mLの吸光度は0.100以下を示します。
標準液0.47ng/mLの吸光度から0ng/mLの吸光度を引いた値は、0.030以上を示します。
標準液30.0ng/mLの吸光度から0ng/mLの吸光度を引いた値は、1.000以上を示します。
2.正確性試験
3種類の管理検体の測定値は既知濃度の±30%以内の値を示します。
3.同時再現性試験
3種類の管理検体を2重測定で同時に4回測定するとき、測定値の変動係数はいずれも20%以下の値を示します。
4.測定範囲
自社施設にて、測定試料として前処理済み尿検体を用いた試験の結果、ヒトアクアポリン2の測定範囲は0.27~30.0 ng/mL(前処理前の尿検体での測定範囲は、容積補正として1.3倍した0.35~39.0 ng/mL)と設定しました。
本キットの有効期間は製造日より18ヵ月間です。なお、使用期限はキットの外箱に表示してあります。必ず2~8℃で保存してください。また、別包装の標準品は-20℃以下で保存してください。
4回までの分割使用が可能です。残りの構成試薬は密閉して2~8℃で保存してください。別包装の標準品は-20℃以下で保存してください。(分割使用の場合は、プレートシールは必要分を切り取り使用してください。)
製造番号の異なるキット構成試薬を組み合わせて使用しないでください。製造番号は同じキットであっても、異なるパッケージの構成試薬、抗体プレートを組み合わせて使用しないでください。
必ず各構成試薬を20~30℃に戻してから使用してください。
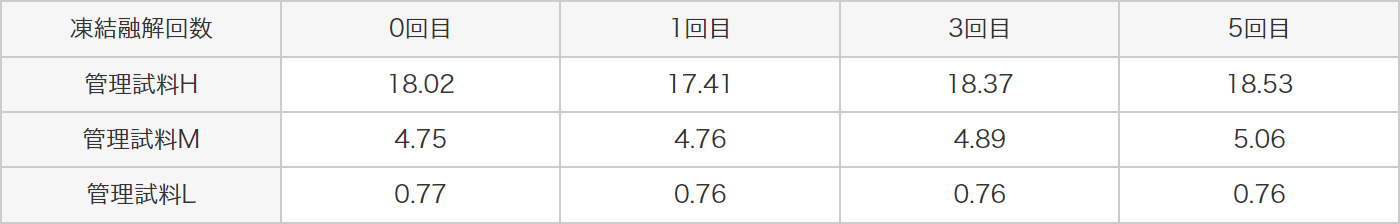
0回~7回まで凍結融解を行った標準品の標準曲線より、4種類の管理試料の濃度を算出した結果、標準品の凍結融解7回まで測定への影響はありませんでした。
プレートのウェルに測定試料を投入する際に生じるタイムラグの影響を確認しました。同一プレートでサンプリングに要する時間を、0、15、30分間にしたとき測定への影響はありませんでした。
プレートウォッシャーが無く、すべての洗浄操作を手作業で実施した場合の測定への影響はありませんでした。
- 【洗浄操作方法】
- 1プレートに入っている液をデカントで廃棄した後、速やかにペーパータオルに叩き付けて残液を完全に吸収・除去する。
- 2各ウェルに300μLの洗浄液を入れる。
- 3デカントで廃棄する。
- 4(2)~(3)をさらに2回繰り返す。
- 5プレートに入っている液をデカントで廃棄した後、速やかにペーパータオルに叩き付けて残液を完全に吸収・除去する。
サンプリング時の標準操作法は、あらかじめ1次反応用緩衝液を各ウェルに100μLずつ加えた後、各濃度の標準液及び検体を各ウェルに50μLずつ加えます。操作を間違えて、先に各濃度の標準液及び検体を各ウェルに50μLずつ加えた後、1次反応用緩衝液を各ウェルに100μLずつ加えた場合の影響を確認した結果、測定への影響はありませんでした。
3種類の管理試料を用いて振とう回転数(振とう機Labinco LD-45)の影響を検討した結果、回転数依存的な吸光度の変動が確認されました。しかし、下図に示すように400~800rpm間ではほぼ同じ測定値が得られることから、振とう回転数は400~800rpmで測定することが可能です。ただし、他の機種では回転数が異なる可能性があります。
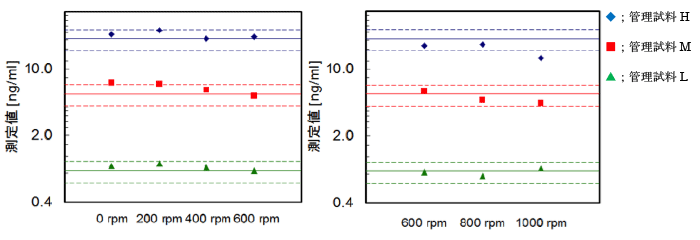
DELFIA プレートシェイカー:1296-004(メーカー名;PerkinElmer)を用いた場合、
600rpm及びLow(約920rpm)ではLabincoの振とう機600rpmとほぼ同じ測定値が得られることが確認されました。(社内データ)DEIFIA プレートシェイカー(1296-004)を用いた場合は、回転数を600rpmに合わせるか、目盛Low(約920rpm)で測定することが可能です。
Micro Mixer振とう機:MX-4(メーカー名;SANKO JUNYAKU)を用いた場合、
670rpm及び回転数目盛2.5(約990rpm)ではLabincoの振とう機600rpmとほぼ同じ測定値が得られることが確認されました。(社内データ)Micro Mixer振とう機(MX-4)を用いる場合は、回転数を670rpmに合わせるか、目盛2.5(約990rpm)で測定することが可能です。
3種類の管理試料を用いて反応温度の影響を検討した結果、反応温度依存的な吸光度の変動が確認されました。しかし、20℃~30℃間ではほぼ同じ測定値が得られますので、必ず20℃~30℃で反応してください。
3種類の管理試料を用いて反応時間の影響を検討した結果、110~130分間の間ではほぼ同じ測定値が得られました。
3次反応はオーバーナイトすることが可能です。オーバーナイトする際は、4℃、17時間静置してください。
3種類の管理試料を用いて抗ヒトアクアポリン2抗血清原液及び酵素標識抗ウサギIgG抗体の希釈倍率の影響を検討した結果、希釈倍率依存的な吸光度の変動が確認されましたが、168~234倍希釈の間ではほぼ同じ測定値が得られました。
各濃度の標準液及び検体の吸光度から標準液0ng/mLの吸光度(ブランク値)の平均値を差し引いて、各実質吸光度を算出してください。X軸に標準液の濃度を、Y軸にその実質吸光度をプロットしてください。各プロットに適当な回帰曲線を当てはめ(例:4パラメーターロジスティック回帰曲線等)、検量線を作成してください。
0.27~30.00ng/mL(前処理前の尿検体での測定範囲は、容積補正として1.3倍した0.35~39.0 ng/mL)のヒトアクアポリン2を測定することが可能です。自社施設において、測定試料として前処理済み尿検体を用いた試験の結果、検出下限は0.17ng/mL、定量限界は0.27ng/mLでした。
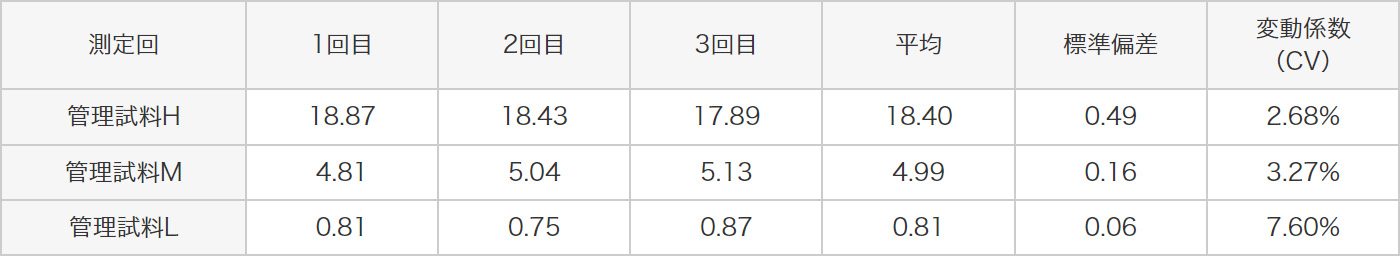
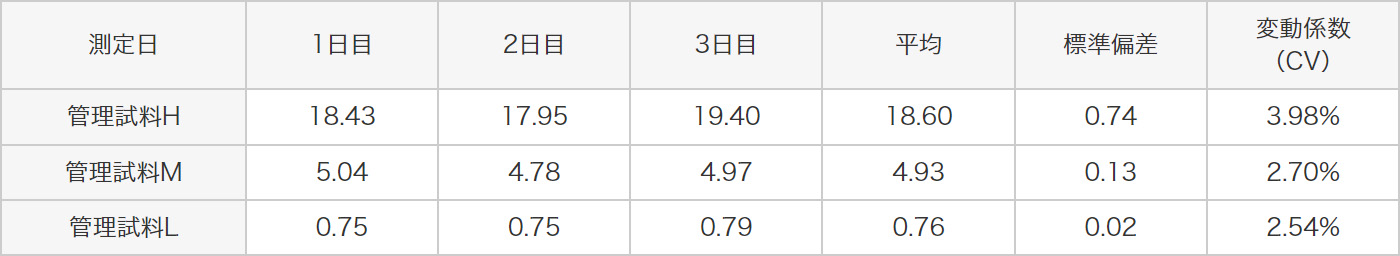
3種類の管理試料(H、M、L)を同時に4回測定した時の、測定日内再現性試験、測定日間再現性試験、さらに3名の異なる測定者により測定者間再現性試験を行ったとき、以下に示すように全ての試験の変動係数(CV)が20%以下と良好な結果を示しました。
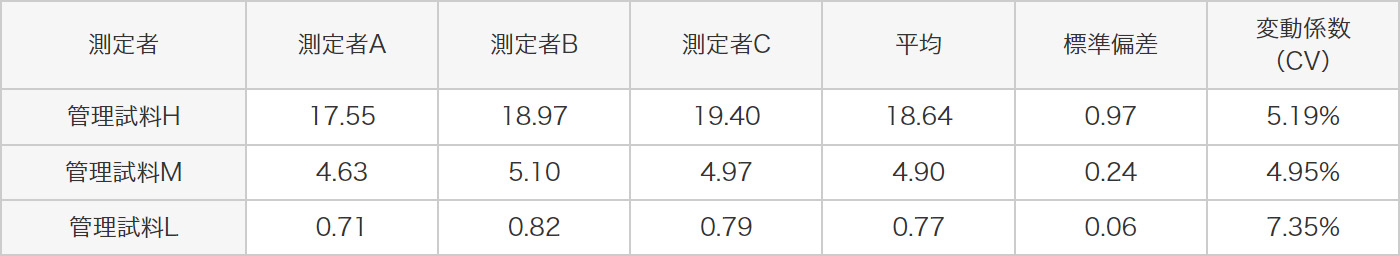
3種類の管理試料(H、M、L)と各濃度の標準液を等量混和した試料を測定しました。ヒトアクアポリン2の測定値を求め、理論値から回収率の評価を行いました。その結果、以下に示すように理論値の±25%以内で良好な結果が得られました。
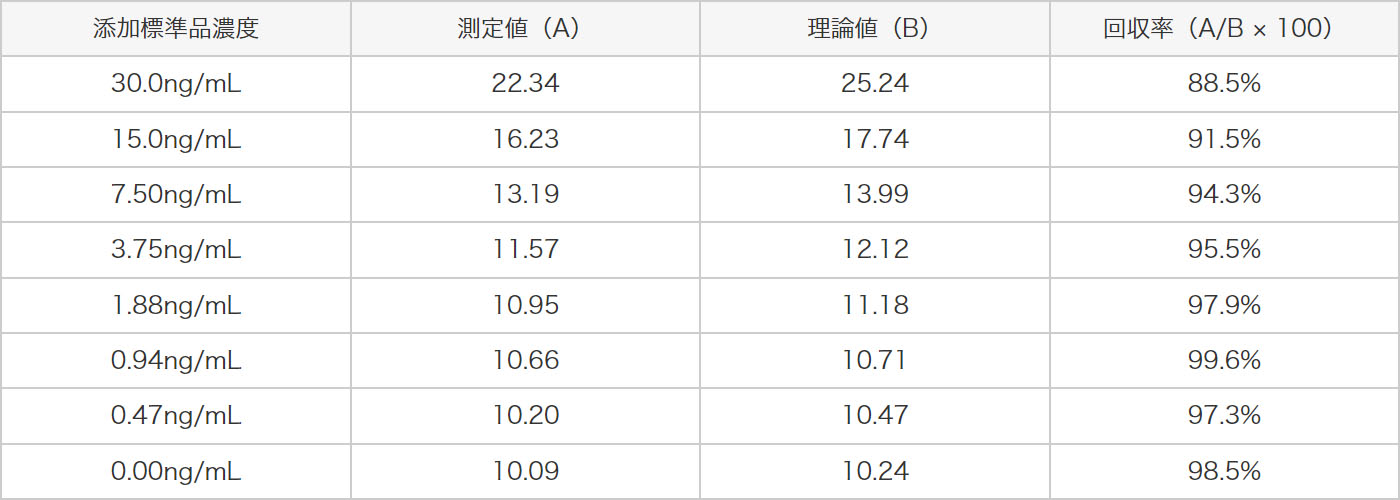
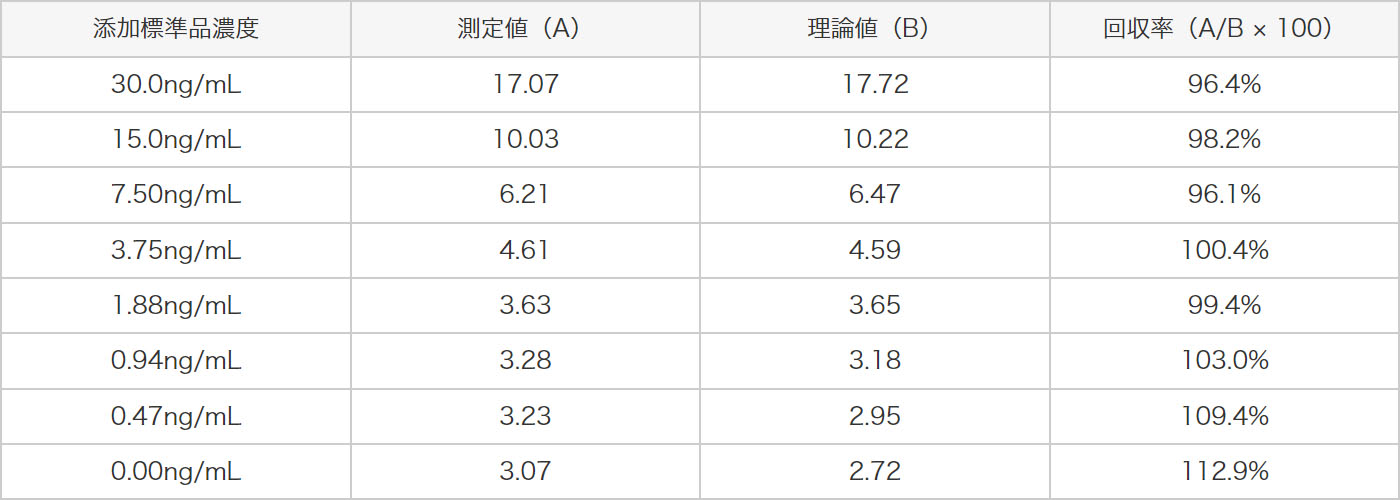
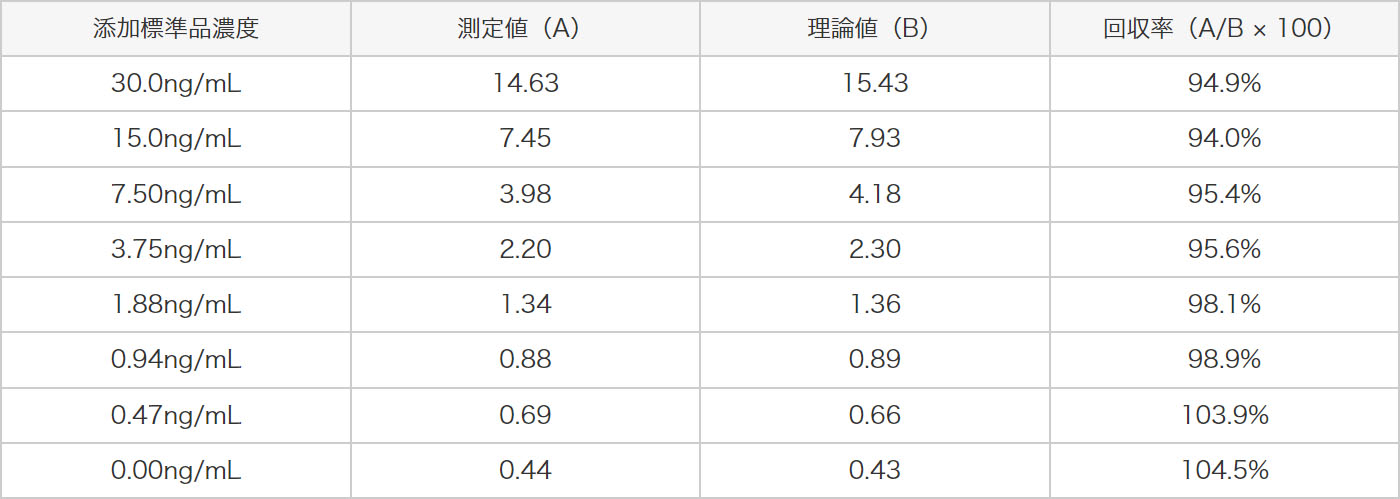
希釈調整した抗ヒトアクアポリン2抗血清液を2分割し、一方を冷蔵で、他方を25℃で保管し、4時間後に測定に供した結果、測定への影響はありませんでした。
希釈調整した酵素標識抗ウサギIgG液を2分割し、一方を冷蔵で、他方を25℃で保管し、6時間後に測定に供した結果、測定への影響はありませんでした。
調整した基質液を2分割し、一方を冷蔵で、他方を25℃で保管し、3時間後に測定に供した結果、測定への影響はありませんでした。
反応停止液を添加した後、直後、30分後、1時間後、2時間後に吸光度を測定した結果、測定への影響はありませんでした。
測定可能な検体はヒトの尿です。尿検体は前処理後、測定に使用してください。このとき尿沈さを除去しないでください。沈さ中にもAQP2が存在するため均一に攪拌し、沈さも含めて素早く採取してください。
尿検体を輸送する場合は冷蔵で行ってください。5種類の尿検体は、冷蔵又は-20℃以下で保存した場合、9ヵ月まで測定への影響はありませんでした。
3種類の尿検体を5回まで凍結融解を繰り返した後、前処理を行ったとき、測定への影響はありませんでした。
尿検体の測定には必ず前処理が必要です。
前処理の静置時間に関して検討を行った結果、10~30分間では測定への影響はありませんでした。前処理の静置時間は10~30分間で測定することが可能です。
前処理済み尿検体中の沈さはサンプリングしないでください。
前処理済み尿検体である3種類の管理試料を用いて、前処理済み尿検体は30℃で保存した場合は、24時間まで、冷蔵では7日まで測定への影響はありませんでした。2種類の前処理済み尿検体は、冷蔵又は-20℃以下で保存した場合は、80日まで測定への影響はありませんでした。
前処理済み尿検体である3種類の管理試料を用いて、7日目までの冷蔵及び30℃保存での安定性を検討した結果、30℃保存では測定値の低下を認めていますので、いずれの検体においても、1日以上の室温保存は避けて、8℃以下で保存してください。
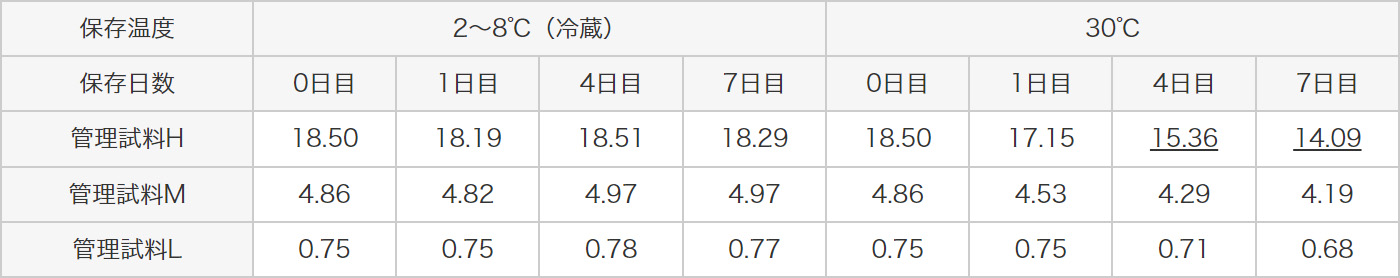
下線:規格外
前処理済み尿検体である3種類の管理試料を用いて5回まで凍結融解を繰り返したとき、測定への影響はありませんでした。