大塚製薬株式会社
腎臓の希少疾病ADPKD患者さんのための錠剤
「サムスカ®錠30mg」を国内で発売
- 「サムスカ錠」は、常染色体優性多発性のう胞腎(ADPKD*1)の世界で初めての治療薬として2014年3月24日に日本で承認された。この度ADPKDの患者さんが錠剤数を少なくして服用できる「サムスカ錠30mg」を発売
- のう胞が多数でき腎臓が大きくなる遺伝性の疾病であるADPKDは、主に腎臓内科、泌尿器科の医師が専門医として患者さんを治療しているが、ADPKDの薬剤治療にあたり、「サムスカ」の適正使用を理解していただくためにe-Learning受講が必須
- 未だ専門医の数は限られており、専門医が増えることが患者さんから切望されている。現在、約700名の医師がe-Learningを受講し、「サムスカ」の処方が徐々に開始されている。今後もADPKDの情報や「サムスカ」の安全性情報を届けていく
大塚製薬は、「サムスカ」を服用されるADPKD患者さんの安全性確保のために、主治医に対する使用上の注意喚起、安全性情報の収集とフィードバックに注力し、本剤の適正使用を進めてまいります。
- ※ 本剤は、適正使用について理解していただくためのe-Learningを受講した医師(登録医)のみ処方が可能です。
- ※ 本剤の使用にあたっては、留意事項がありますので「サムスカ」の概要を参照ください。
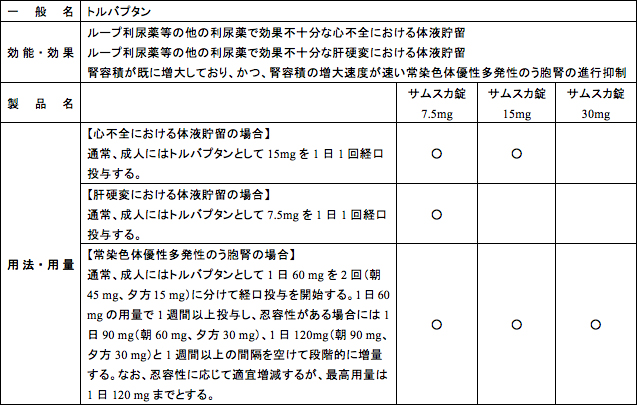
大塚製薬株式会社(本社:東京都、代表取締役社長:岩本太郎、以下「大塚製薬」)は、「腎容積が既に増大しており、かつ、腎容積の増大速度が速い常染色体優性多発性のう胞腎の進行抑制」の効能・効果に使用する「サムスカ®錠30mg(一般名:トルバプタン)」を既存の7.5mg錠及び15mg錠に加え新たな製剤として2014年5月29日から発売します。既に2014年3月24日に既存の7.5mg錠及び15mg錠に対して、この新効能・効果が追加承認され医療現場で使用され始めていますが、患者さんの服用錠剤数を少なくして利便性をより向上させるために、この度、高含量の30㎎錠を発売します。
ADPKDは、腎臓にのう胞(液体が詰まった袋)が無数にできて腎臓が大きくなり、腎機能が低下していく遺伝性の病気です。両親のいずれかがADPKDの場合、2人に1人の割合で子どもに遺伝する可能性があります。遺伝性の疾患のなかでも発症頻度が高く約4,000人に1人が患っていると推定され、日本には約3万人※2、欧州には約20万人※3、米国には約12万人※4の患者さんがいます。患者さんには身体的、精神的、社会的負担があります。痛みなどの身体的な負担だけでなく、いつ発症するか、いつ透析が必要になるのかという不安や、子供に遺伝しているかもしれないという精神的負担も抱えています。さらに保険加入の可否などといった社会的負担も抱えています。
多くの場合は30~40歳代以降に症状が現れ、血尿、腹痛・腰背部痛、腹部膨満などが見られます。また、腎機能が低下する前から高血圧を合併することが多く、脳動脈瘤や肝のう胞なども高い頻度で合併します。腎機能が低下してくると透析または腎移植が必要(透析の原因疾患のうち第4位がADPKD)となり、70歳までに半数近くの患者さんが末期腎不全に至り、透析治療または腎移植を余儀なくされます。根本的な治療方法は確立されておらず有効な治療薬もないため、ADPKDを正確に診断して治療を施すことができる医師の数は限られています。主に腎臓内科、泌尿器科の専門医が治療をしていますが、さらに多くの専門医が切望されています。
大塚製薬はADPKDの情報や「サムスカ」の安全性情報を届ける努力を下記のように行っています。
【ADPKD治療の「サムスカ」適正使用のための取り組み】
- e-Learningシステム:医師がADPKDと「サムスカ」の適正使用について的確に理解し、処方医として登録するためのシステム
- ADPKDウェブサイト:ADPKDの診断・症状などについて解説するウェブサイト
( http://www.ADPKD.JP)
http://www.ADPKD.JP) - 「サムスカ錠」関連資料:医師向け(適正使用)・薬剤師向け(調剤制限)・患者さん向け(注意事項)
大塚製薬は、ADPKDの患者さんのための専門医が全国で増えることを目指し、医療従事者とともによりよい治療環境の構築に努めてまいります。
【サムスカについて】
「サムスカ」は、医療現場の医師からの「水だけを出す利尿剤が欲しい」という要望を受け、大塚製薬の徳島研究所でバソプレシンV2-受容体拮抗剤の研究が始まり、26年の歳月をかけて開発された薬剤です。水だけを出す経口利尿剤を世界に先駆け開発したのは大塚製薬が初めてでした。現在、世界14カ国で使用されています。一方で、バソプレシンV2-受容体を介したcAMP産生の抑制によりADPKDの腎のう胞の増殖・増大を抑制することが2003年に発表され※5、大塚製薬はもう一つの新たな挑戦として2004年から、米国メイヨー・クリニックのヴィセンテ・E・トーレス教授を筆頭に、希少疾病であるADPKDの治療薬開発に取り組んできました。世界15カ国で1,400人以上のADPKD患者さんを対象に行われた国際共同臨床試験(TEMPO3:4試験※6)において「サムスカ」は、プラセボと比較し腎臓の容積の増加率を約50%有意に抑制することが証明されました。この試験結果は2012年11月にニューイングランド・ジャーナル・オブ・メディシン誌に掲載されました※7。
- ※1 Autosomal Dominant Polycystic Kidney Disease
- ※2 Higashihara E, et al. Prevalence and renal prognosis of diagnosed autosomal dominant polycystic kidney disease in Japan. Nephron.1998;80:421-427
- ※3 EMA資料、EU/3/13/1175.2013
http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/orphans/2013/09/human_orphan_001257.jsp&mid=WC0b01ac058001d12b - ※4 Data on File. Tolvaptan: ADPKD Epidemiology Study Reporting Diagnosed Cases, TOLV-002
- ※5 Gattone, VH et al. "Inhibition of renal cystic disease development and progression by a vasopressin V2 receptor antagonist"
Nature Medicine, 2003: 9 (10): 1323-1326 - ※6 Tolvaptan Efficacy and Safety in Management of Autosomal Dominant Polycystic Disease and its Outcomes
- ※7 Torres, VE et al. "Tolvaptan in Patients with Autosomal Dominant Polycystic Kidney Disease". The New England Journal of Medicine, 2012: 367 (25): 2407-2418
「サムスカ」の概要
ADPKDに対する使用にあたっては、留意事項がありますのでお知らせいたします。
- 本剤は、適正使用について理解していただくためのe-Learningを受講した医師(登録医)のみ処方が可能です。
- 薬局においては、登録医による処方であることが確認された場合のみ調剤を行います。
- 本剤投与開始に先立ち、本剤は疾病を完治させる薬剤ではないことや重篤な肝機能障害が発現するおそれがあること、適切な水分摂取及び定期的な血液検査等によるモニタリングの実施が必要であることを含め、本剤の有効性及び危険性について医師は患者に十分説明し、文書による同意を得る必要があります。
これらの留意事項は、本剤の重篤な高ナトリウム血症や肝機能障害などのリスクを踏まえ、本剤投与によるベネフィットが上回る適切な投与患者の選定や、患者ご自身による同意、少なくとも投与開始時は入院下で行うこと、及び本剤投与中の血清ナトリウム濃度や肝機能検査のモニタリングなどを徹底するために、求められるものです。
【参考資料】
国際共同臨床試験(TEMPO3:4試験)について
この試験は、世界15カ国※1,445人のADPKD患者さんを対象に3年間にわたりトルバプタンもしくはプラセボが投与された国際共同臨床試験です。本試験では、ADPKDの進行に対する有効性と安全性の評価が行われました。その結果トルバプタンは、プラセボと比較し腎臓の容積の増加率を約50%有意に抑制することが示されました。トルバプタンは、バソプレシンV2-受容体拮抗作用により、バソプレシンによる細胞内cAMP の産生を抑制することで腎のう胞の増大を抑制すると考えられています。
- ※ 米国、日本、ドイツ、フランス、ポーランド、オーストラリア、イギリス、ベルギー、イタリア、オランダ、アルゼンチン、カナダ、ルーマニア、ロシア、デンマーク
「サムスカ」のグローバル展開について
大塚製薬が創製した「サムスカ」は、選択的にバソプレシンV2-受容体を阻害することによって腎のう胞の増大を抑制し、常染色体優性多発性のう胞腎(ADPKD)の進行を抑制するファーストインクラスの治療薬として世界で初めての承認となります。欧州においては2013年12月に申請受理されており、米国では追加試験を実施予定です。
「サムスカ」は、26年をかけて開発された水だけを出す利尿剤として米国、欧州を始め世界14カ国で使用されています。米国では2009年6月に低ナトリウム血症で発売、欧州では同年9月に抗利尿ホルモン不適合分泌症候群(SIADH)による低ナトリウム血症の治療で発売されています。日本では、2010年に心不全における体液貯留、2013年に肝硬変における体液貯留で発売しました。現在は、その他の体液貯留性の疾患を対象とした開発を進めています。






