研究開発
研究者主導研究の支援について
弊社は、以下の重点領域を中心にUnmet Medical Needsを解決するための研究者主導研究(以下 ISS:Investigator-Sponsored Studies)を支援致します。
支援申請は、弊社米国法人「大塚アメリカファーマシューティカル社(以下 OAPI:Otsuka America Pharmaceutical, Inc)」と共通のWebシステムを介して実施していただきます。
研究者から支援申請された研究計画について、厳密な審査を行ったうえで支援の可否を決定し、所定の要件を満たす契約を締結して研究費等を提供します。
なお、研究支援は、弊社製品の推奨及び処方促進を目的としたものではありません。
重点領域
下記の臨床研究(介入研究、観察研究、疫学研究、非臨床研究等)
次の研究は、本システムでは受け付けておりません。下記問い合わせ先にご連絡ください。
- ※デラマニド/フレマネズマブに関する臨床研究
- ※医師主導治験、先進医療B、患者申出療養
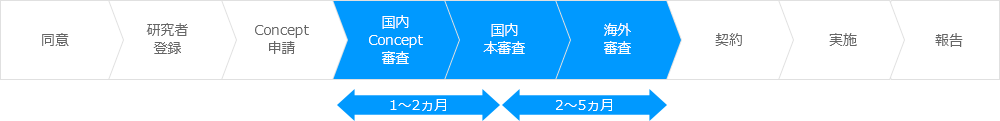
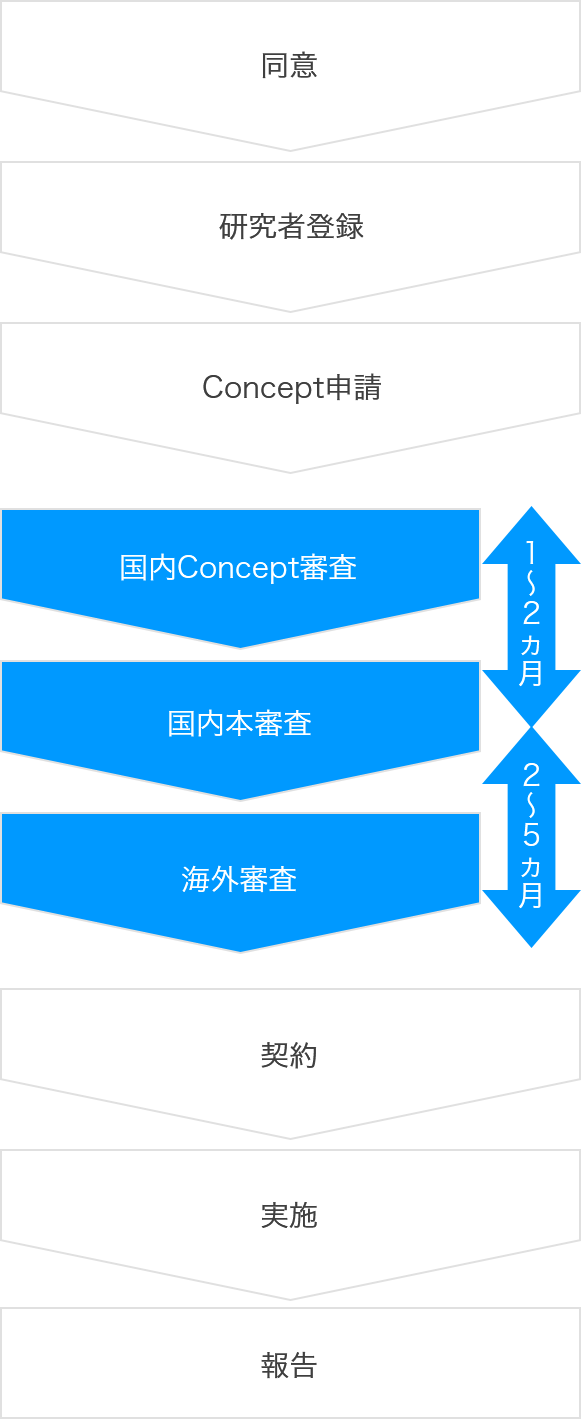
研究実施までの流れ
お問い合わせ先
本システムに関する質問は以下にお願いします。
(デラマニド/フレマネズマブに関する臨床研究、基礎研究、医師主導治験、先進医療B、患者申出療養はこちらからお問い合わせ下さい。)
ISS支援に関する確認事項
本システムからの申請にあたり、以下の全ての項目をご確認ください。
- ※本文中の「研究責任(代表)者」は、特定臨床研究の場合は「研究責任(代表)医師」と読み替えてください。
- 1申請する研究計画書は次の条件を満たすことが必要です。(弊社は、研究計画の根幹に係る内容について指示、要求、依頼することはありません。)
- 研究者あるいは研究組織自らが企画・立案したもの(ISS)である。
- ヘルシンキ宣言、人を対象とする生命科学・医学系研究に関する倫理指針等の倫理指針、臨床研究法等、適用される法規制に基づいて実施する。
- 医薬品を用いた臨床研究を行う場合、効能・効果及び用法・用量の承認の範囲内である。
- 研究の実施が可能な組織・体制が構築されること。
- デラマニド/フレマネズマブに関する臨床研究以外である。
- 2申請に際しては、次の書類等の提出が必要です。
- 研究計画書概要(英語、日本語どちらでも可)
- 研究責任者の履歴書(CV)
- 必要に応じて、モニタリング計画書及び監査計画書(概要でも可。研究計画書概要に詳細の記載がない場合、提出が必要です。)
- 研究を完遂することができる研究費総額とその算定根拠を記した文書
- ISS支援に関する確認書
- 3支援は、日本製薬工業協会が定めた「医療用医薬品等を用いた研究者主導臨床研究の支援に関する指針(2016年1月21日制定・2020年10月12日改定)」に従います。主な留意事項は下記の通りです。
- 研究費又は薬剤の提供に限ります。また、研究責任(代表)者及び共同研究者(論文の共著者等)の人件費は支援できません。なお、研究の実施に係る一切の責任は負いません。
- 「医療用医薬品製造販売業公正競争規約」又は「医療機器業公正競争規約」に従って支援いたします。
- 間接費を計上される場合には、当該研究に用いられるものに限り、その算定根拠が必要です。詳細は上記日本製薬工業協会の指針をご参照下さい。
- 業務委託及び結果報告等の費用は、実費のみ負担致します。
- 研究終了後、収支報告書を提出いただき、残余研究費は返還していただきます。
- 4審査結果は、e-mailで以下いずれかの回答をさせていただきます。
- 承認 : 契約の手続きに進んでいただきます。
- 修正の上承認 : 研究費の額等について協議させていただき、合意に至る場合、契約の手続きに進んでいただきます。
- 否認 : 支援できません。なお、否認となった理由の詳細はお伝えできません。予め、ご了承ください。
- 5支援に際しては、弊社の支援条件を含む契約書を用いて、研究責任(代表)者が所属する研究機関の長と契約を締結いたします。
主たる支援条件は、下記の通りです。
- 認定臨床研究審査委員会等で承認された、研究計画書及び研究対象者への説明文書・同意文書の初版及び改訂版を提出していただきます。
研究計画の内容が、審査時の研究計画書概要から大きく変更される場合、支援を中止(契約解除)させていただくことがあります。 - 有害事象及び弊社が指定する安全性情報を弊社宛に報告していただく必要があります。 その報告手順等は研究計画書内に明記いただきます。
- 契約書に従い、研究の進捗状況を弊社と合意した頻度(最長6か月ごと)で報告していただきます。
- 研究終了(データ固定)後10ヵ月以内に、弊社と合意した記載項目を含む最終研究結果報告書(Final Study Report)の完成版を提出して頂きます。
- 認定臨床研究審査委員会等で承認された、研究計画書及び研究対象者への説明文書・同意文書の初版及び改訂版を提出していただきます。
- 6臨床研究法および、日本製薬工業協会の「企業活動と医療機関等の関係の透明性ガイドライン」に従って定められた弊社のルールに基づき、研究機関名と支援金額(研究費)等を弊社ホームページ等で公開します。
- 7提供された個人情報は、当該選考・結果報告を目的として使用し、これに係る大塚製薬株式会社、大塚アメリカファーマシューティカル社(OAPI)及び大塚ファーマシューティカルD&C社以外に提供することはありません。
詳しくは、個人情報・特定個人情報保護宣言をご覧下さい。
作成日:2018年8月27日
改訂日:2020年12月22日
改訂日:2021年7月1日
改訂日:2021年8月2日
改訂日:2022年6月27日
上記「ISS支援に関する確認事項」に同意いたします。






