医療関連事業 製品情報
患者さんたちに届けること。
これが、大塚製薬が革新的な製品開発に
挑戦し続ける理由です。
中枢神経領域

レキサルティ
大塚製薬が創製した、SDAM(Serotonin-Dopamine Activity Modulator)と呼ばれる独自の薬理作用をもつ治療薬で、ルンドベック社とグローバル共同開発・共同販売しています。米国で2015年から成人の大うつ病の補助療法と統合失調症の適応で承認され、現在、日本を含めた約60の国・地域で展開しています。2023年には、米国で初めてとなる「アルツハイマー型認知症に伴うアジテーション」の効能追加の承認を米国FDAより取得し、日本でも同じ効能(1)で2024年に承認されました。
(1) 適応症は、「アルツハイマー型認知症に伴う焦燥感、易刺激性、興奮に起因する、過活動又は攻撃的言動」
- ※製品説明文に記載された情報は、2025年7月現在の内容です。
エビリファイ メンテナ(海外)
エビリファイ持続性水懸筋注用(日本)
エビリファイ メンテナ(海外)
大塚製薬が創製した抗精神病薬「エビリファイ」の持続性注射剤です。1ヵ月製剤は統合失調症の適応症で2013年に米国、2015年に日本で発売し、現在は50以上の国・地域で販売されています。2017年に米国、カナダで成人の双極Ⅰ型障害維持療法の効能追加、2020年に日本で双極Ⅰ型障害における気分エピソードの再発・再燃抑制の効能が追加されました。
2ヵ月製剤(米国製品名:エビリファイ アシムトファイ)は、成人の統合失調症と双極Ⅰ型障害の単剤維持療法の適応で、2023年に米国FDAより製造販売承認を取得しました。
- ※製品説明文に記載された情報は、2025年7月現在の内容です。

エビリファイ
大塚製薬が創製した世界初のドパミンD2受容体パーシャルアゴニスト作用をもつ抗精神病薬です。日本では2006年に統合失調症の適応で発売し、2012年に双極性障害の躁症状の改善、2013年にうつ病・うつ状態、2016年に小児期の自閉スペクトラム症に伴う易刺激性の適応を追加しました。
- ※製品説明文に記載された情報は、2025年7月現在の内容です。

パーキンソン病治療剤
レストレスレッグス症候群治療剤
レストレスレッグス症候群治療剤
ニュープロ パッチ
1日1回貼るだけで24時間安定した血中濃度を維持する、世界で唯一の経皮吸収型ドパミンアゴニストのパッチ製剤です。2002年に日本国内における独占的開発・販売権をベルギーのUCB社から取得し、2013年に発売しました。
- ※製品説明文に記載された情報は、2025年7月現在の内容です。
セリンクロ
アルコール依存症患者さんに対する飲酒量低減を目的とした国内で初めての薬剤です。飲酒の1~2時間前に服用することで、中枢神経系に広く存在するオピオイド受容体調節作用を介して飲酒欲求を抑えることにより飲酒量を低減すると考えられています。2013年よりルンドベック社と日本における共同開発を開始し、2019年に発売しました。
- ※製品説明文に記載された情報は、2025年7月現在の内容です。

アジョビ
テバファーマスーティカル・インダストリー社から導入した、抗CGRP(Calcitonin Gene-related Peptide:カルシトニン遺伝子関連ペプチド)モノクローナル抗体の皮下注射剤です。片頭痛発作の発症に重要な働きをしているとされるCGRPに結合してCGRP受容体との結合を阻害することで、片頭痛発作の発症を抑制すると考えられています。大塚製薬は2017年に日本国内における開発・販売権を取得し、2021年に発売しました。
- ※製品説明文に記載された情報は、2025年7月現在の内容です。
がん領域
チロシンキナーゼインヒビター
チロシンキナーゼインヒビター
アイクルシグ
米国アリアド社(2017年に武田薬品工業株式会社が買収)が創製した経口チロシンキナーゼ阻害薬(TKI)です。既存のTKIで効果が不十分な慢性骨髄性白血病とフィラデルフィア染色体陽性急性リンパ性白血病の適応で、2016年から日本で販売しています。
- ※製品説明文に記載された情報は、2025年7月現在の内容です。
ブスルフェクス
血液がん患者さんの造血幹細胞移植の前治療薬として認可された薬剤です。2007年に権利を継承し、世界各国の移植医療を支える標準治療として販売されています。
- ※製品説明文に記載された情報は、2025年7月現在の内容です。
循環器・腎領域

ジンアーク(海外)※
※ADPKD治療薬の海外製品名
サムスカ
ジンアーク(海外)※
大塚製薬が創製した、抗利尿ホルモンであるバソプレシンの働きを抑制することで、電解質排泄に影響を与えずに水のみを体外へ排泄する新しい作用機序を持つ水利尿剤です。日本では2010年に心不全の浮腫(体液貯留)で発売され、2013年に肝硬変患者さんの浮腫の適応が追加されました。さらに、2014年には世界初となる常染色優性多発性のう胞腎(ADPKD)の治療薬として日本で承認されました(2015年に欧州、2018年に米国でも承認)。現在、サムスカ/ジンアークは40以上の国・地域で承認されています。
- ※製品説明文に記載された情報は、2025年7月現在の内容です。
サムタス
大塚製薬が創製したV2-受容体拮抗剤トルバプタンのプロドラッグ注射剤で、静脈内投与後に速やかにトルバプタンへと加水分解されます。心不全における体液貯留の適応で、2022年から日本で販売しています。
- ※製品説明文に記載された情報は、2025年7月現在の内容です。

プレタール
大塚製薬が創製した血小板凝集抑制と末梢血管拡張作用を持つ抗血小板剤です。日本では慢性動脈閉塞症の適応で1988年に発売され、2003年には脳梗塞の再発抑制の適応が追加されました。また、2010年にプレタールOD錠を発売しました。
- ※製品説明文に記載された情報は、2025年7月現在の内容です。
ルプキネス
オーリニア社から導入した、ループス腎炎を対象に開発された新規の経口免疫抑制剤です。T細胞の増殖・活性化に重要な酵素であるカルシニューリンを阻害することで免疫抑制作用を発揮すると考えられています。大塚製薬は2022年に欧州委員会(EC)より本剤の販売承認を獲得し、日本においても2024年に発売しました。
- ※製品説明文に記載された情報は、2025年7月現在の内容です。
消化器領域
ムコスタ
大塚製薬が創製した、胃に生じるフリーラジカルや炎症を抑えるとともに、胃粘膜を保護する作用をもつ治療薬として、1990年から日本で販売を開始しました。鎮痛薬の服用やヘリコバクター・ピロリ菌の影響など、様々な原因によって起こる胃粘膜傷害を抑制する薬剤として広く使用されています。
- ※製品説明文に記載された情報は、2025年7月現在の内容です。
感染症領域
デルティバ
大塚製薬が創製した、結核菌の細胞壁を構成するミコール酸の生成を阻害することにより殺菌効果を示す、新たなメカニズムを有する治療薬です。約40年ぶりとなる新規抗結核薬の一つとして、成人における多剤耐性肺結核の適応で2014年に欧州、日本で承認を取得し販売しています。2015年には、WHO必須医薬品リストに掲載されました。現在では120カ国以上で使用が可能になっています。
- ※製品説明文に記載された情報は、2025年7月現在の内容です。
眼科領域

ムコスタ点眼液
大塚製薬が創製した角膜および結膜のムチン産生を促進し、角膜と結膜の障害を修復する作用を持つドライアイ治療剤です。ユニットドーズ(1回使い切りタイプ)製剤として、2012年から日本で販売しています。
- ※製品説明文に記載された情報は、2025年7月現在の内容です。
ミケルナ配合点眼液
大塚製薬が創製したカルテオロール塩酸塩点眼液「ミケランLA点眼液」と、プロスタグランジン関連薬であるラタノプロストの2つの有効成分を配合した1日1回の点眼液です。2017年から日本で販売しています。
- ※製品説明文に記載された情報は、2025年7月現在の内容です。
皮膚科領域
モイゼルト
大塚製薬が創製した、ホスホジエステラーゼⅣ(以下「PDE4」)阻害剤です。PDE4阻害剤は、炎症性サイトカインなどの化学伝達物質の産生を抑制し、抗炎症作用を発揮することでアトピー性皮膚炎の症状を改善すると考えられています。成人と小児(3か月以上)を対象とした国内初のアトピー性皮膚炎の適応を持つ外用PDE4阻害剤として、2022年から日本で販売しています。
- ※製品説明文に記載された情報は、2025年7月現在の内容です。
診断薬、医療機器 ほか

ユービット
大塚製薬が開発した、ヘリコバクター・ピロリ菌の感染診断用剤です。服用前後の呼気を測定することで感染の有無を簡便に検査できます。
- ※製品説明文に記載された情報は、2025年7月現在の内容です。
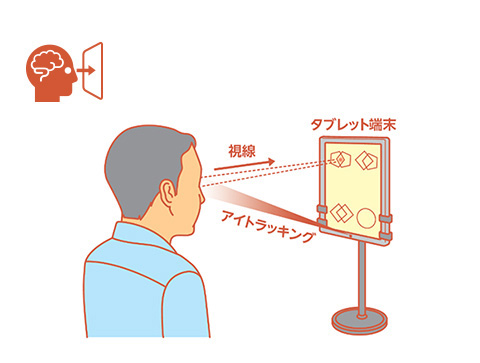
ミレボ
株式会社アイ・ブレインサイエンスが開発したアイトラッキング(視線計測)技術を用いて行う神経心理検査用プログラムです。認知症領域のプログラム医療機器(SaMD)として国内で初めて保険適用を取得し、2025年に発売されました。
- ※製品説明文に記載された情報は、2025年7月現在の内容です。

(がんゲノムプロファイリング検査用)
ヘムサイト診断薬
(がんゲノムプロファイリング検査用)
ヘムサイト解析プログラム
2025年に国内で初めて保険適用・発売された造血器腫瘍及び類縁疾患を対象とした遺伝子パネル検査です。
ヘムサイトは膨大なゲノム情報の解析により、白血病、悪性リンパ腫や多発性骨髄腫といった患者さんの腫瘍が持つ遺伝子異常を網羅的に検出できます。血液がんにおいて遺伝子異常は、治療薬の選択だけでなく、診断や予後予測にも活用可能な情報であり、治療方針の決定に役立つ可能性があります。
- ※製品説明文に記載された情報は、2025年7月現在の内容です。
研究用試薬
このページでは、大塚製薬の医薬品関連事業をご紹介するにあたり医療用医薬品の画像等を表示しておりますが、使用の推奨を意図するものではありません。