大塚製薬株式会社
飲酒量を低減する治療薬「ナルメフェン」 国内フェーズ3 試験結果の速報について
- ナルメフェンは、アルコール依存症において飲酒してしまうおそれがある場合に服用することで飲酒欲求を抑制する薬剤
- 国内フェーズ3試験において主要評価項目と副次的評価項目を達成
大塚製薬株式会社(本社:東京都、代表取締役社長:樋口達夫、以下「大塚製薬」)とH.ルンドベックA/S(本社:デンマーク、コペンハーゲン、社長兼CEO:コーレ・シュルツ、以下「ルンドベック社」)は、「ナルメフェン(一般名)」のアルコール依存症患者さんを対象とした国内フェーズ3試験(検証試験と長期投与試験)において試験結果の速報が得られましたので、お知らせします。
検証試験は、アルコール依存症患者さん約660名を対象とした多施設共同、プラセボ対照、ランダム化、二重盲検比較試験です。心理社会的治療併用のもと、ナルメフェン10mg/日投与群、20mg/日投与群、プラセボ投与群に分けて24週間投与し、本剤の有効性および安全性を比較検討しました。主要評価項目として、多量飲酒した日数※1のベースラインからの変化量、重要な副次的評価項目として、総飲酒量※2のベースラインからの変化量でアルコール依存症患者さんの飲酒量の低減を検討しています。
長期投与試験は、検証試験の終了後に継続に同意が得られた患者さん約400名を対象としたナルメフェン20mg/日の長期の安全性と有効性を検討する試験です。ナルメフェン20mg/日を24週間投与し、その後にさらにナルメフェン20mg/日群とプラセボ群に分けて4週間投与しました。
- 1多量飲酒した日数(HDDs):1日のアルコール消費量が男性60g超、女性40g超の1ヵ月あたりの日数(日/月)
- 2総飲酒量(TAC):1ヵ月あたりの平均アルコール消費量(g/日)
試験結果速報では、検証試験において、主要評価項目である多量飲酒した日数のベースラインから12週時の変化量において、ナルメフェン10mg投与群、20mg投与群ともにプラセボに比べ有意差が認められました(P<0.0001)。また治療期の24週時まで効果は維持されました。重要な副次的評価項目である総飲酒量でも両投与群ともに有意な低下が認められています(P<0.0001)。長期投与試験においても、多量飲酒した日数、総飲酒量ともに試験終了時まで減少が維持されました。発現した有害事象は、悪心、浮動性めまい、傾眠などであり、多くが軽度または中等度で、長期投与により発現率あるいは重症度が高くなるものはありませんでした。また同剤による依存性や離脱症状は認められておりません。
この試験結果の詳細については、年内に実施される学会で発表する予定です。
精神疾患の中でも、アルコール依存症は自身の健康を損なうだけでなく、社会的・経済的な影響が大きいとされ、対応が急がれています。ナルメフェンは、飲酒のおそれがあるときに服用することで、中枢神経系に広く存在するオピオイド受容体調節作用を介して、飲酒欲求を抑制する薬剤として大塚製薬とルンドベック社が共同で開発を進めてきました。断酒に導くための中間的ステップ、あるいは治療ゴールの一つとして、飲酒量の低減を目的とした同剤は、社会復帰を目指す患者さんにとっても継続的な治療を可能にする新たな選択肢として期待されています。なお、欧州では「Selincro®」(セリンクロ)の製品名で2013年4月からルンドベック社により販売されています。
ナルメフェン(nalmefene)について
ナルメフェンは、選択的オピオイド受容体調節薬です。オピオイド受容体は、中枢神経系に広く分布し、脳内報酬系や情動制御、痛みのコントロールなどを司り、これまでに3つのサブタイプ(μ、κ、δ)が知られています。
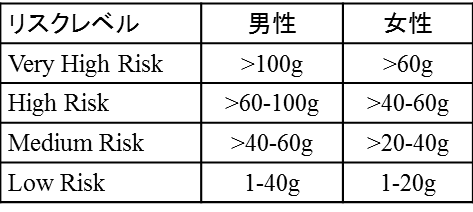
同剤は、μオピオイド受容体及びδオピオイド受容体に対しては拮抗薬として、κオピオイド受容体に対しては部分的作動薬として作用し、飲酒欲求を抑制すると考えられています。既に販売を開始している欧州では、アルコール依存症において、健康リスクが高いとされる飲酒量(下図High Risk およびVery High Risk:成人男性では1日60g超、女性では1日40g超のアルコール摂取)を低減させるという適応をもつ経口治療薬です。
1日の平均飲酒量に基づくリスクレベル