大塚製薬株式会社
抗精神病薬「レキサルティ」 日本における効能追加の承認取得について
‐"アルツハイマー型認知症に伴う焦燥感、易刺激性、興奮に起因する、 過活動又は攻撃的言動"について、国内初となる適応症を取得‐
大塚製薬株式会社(本社:東京都、代表取締役社長 井上眞、以下「大塚製薬」)は、本日、抗精神病薬「レキサルティ®(一般名:ブレクスピプラゾール)」について、国内初となる「アルツハイマー型認知症に伴う焦燥感、易刺激性、興奮に起因する、過活動又は攻撃的言動」の効能効果の承認を取得しましたので、お知らせします。本剤の国内における効能は、「統合失調症」、「うつ病・うつ状態(既存治療で十分な効果が認められない場合に限る)」に加えて、3つ目となります。
このたび日本国内で取得した効能は、米国をはじめとする海外では"アルツハイマー型認知症に伴うアジテーション"として承認されています。国際老年精神医学会において、認知症に伴うアジテーションは、情動的な苦痛を背景要因とする攻撃的な症状と非攻撃的な症状を含み、同じ動作の反復などの活動亢進、攻撃的発言または攻撃的行動のうち少なくとも1つ以上の症状からなり、認知症の方の日常生活、社会生活、人間関係のいずれかに支障を来した状態とされています*1。これらの症状は、アルツハイマー型認知症の約半数で認められ*2,3、介護者の負担を重くし、認知症の方や家族、介護者の生活の質を低下させるとともに家族と同居できず介護施設へ入居せざるを得ない要因の一つとなっています。
本剤の国内フェーズ3試験では、アルツハイマー型認知症に伴うアジテーションを有する55歳から90歳の410名を対象に、ブレクスピプラゾール(1mgまたは2mgを1日1回)を10週間投与し、有効性と安全性を評価しました。ブレクスピプラゾールの1mg群および2mg群はプラセボ群と比較し、いずれも主要評価項目であるCMAI*4合計スコアにおいて、統計学的な有意差をもって有効性を示しました。また、臨床全般印象・重症度スコア(CGI-S*5)など、副次評価項目においても、プラセボ群と比較してブレクスピプラゾールの1mg群および2mg群で改善が認められました。本試験においてブレクスピプラゾールは全般的に良好な忍容性を示し、新たな安全性の懸念は認められませんでした。
大塚製薬 代表取締役社長 井上眞は、「大塚製薬は、心身の健康だけでなく、人々を取りまく社会全体の課題を解決するトータルヘルスケアカンパニーを目指しています。高齢化が加速する日本国内において、このたびのレキサルティの効能追加は、アルツハイマー型認知症の方々と介護者の双方にとって重要な転換点となることが期待されます。大塚製薬は、ご自身とそのご家族・介護者のウェルビーイングに寄り添い、今後も包括的な選択肢を提供する努力を続けてまいります」と述べています。
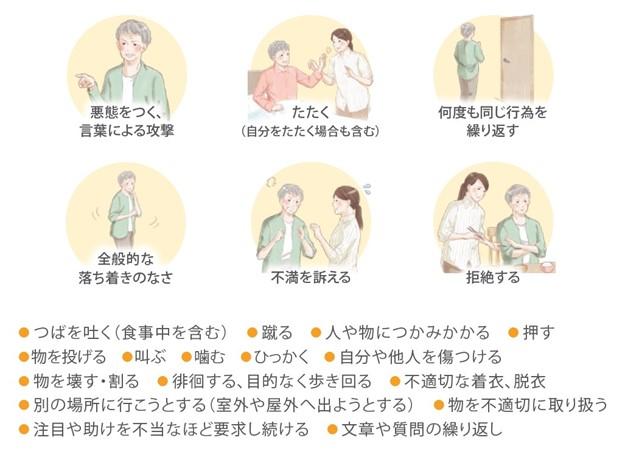
アルツハイマー型認知症に伴う焦燥感、易刺激性、興奮に起因する、過活動又は攻撃的言動の例
レキサルティ®について
新規抗精神病薬「レキサルティ(一般名:ブレクスピプラゾール)」は、大塚製薬が創製した独自の薬理作用を有する化合物です。海外ではルンドベック社と共同開発し、2015年に米国で「成人の大うつ病補助療法」および「成人の統合失調症」の2つの効能で承認され、現在、日本を含めた約60の国・地域で展開しています。2023年5月には、米国で初めてとなる「アルツハイマー型認知症に伴うアジテーション」の治療における効能追加の承認を米国FDAより取得しました。「アルツハイマー型認知症に伴うアジテーション」の効能については、2024年8月時点で、カナダ、フィリピン、台湾でも承認されています。
「レキサルティ」の製品概要 (下線が今回の追加部分)
| 製品名 | レキサルティ®錠1mg、レキサルティ®錠2mg レキサルティ®OD錠0.5mg、レキサルティ®OD錠1mg、レキサルティ®OD錠2mg |
|---|---|
| 一般名 | ブレクスピプラゾール |
| 効能又は効果 | 統合失調症、うつ病・うつ状態(既存治療で十分な効果が認められない場合に限る)、アルツハイマー型認知症に伴う焦燥感、易刺激性、興奮に起因する、過活動又は攻撃的言動 |
| 用法及び用量 | <統合失調症> 通常、成人にはブレクスピプラゾールとして1日1回1mgから投与を開始した後、4日以上の間隔をあけて増量し、1日1回2mgを経口投与する。 <うつ病・うつ状態(既存治療で十分な効果が認められない場合に限る)> 通常、成人にはブレクスピプラゾールとして 1 日 1 回1 mg を経口投与する。なお、忍容性に問題がなく、十分な効果が認められない場合に限り、1 日量 2 mg に増量することができる。 <アルツハイマー型認知症に伴う焦燥感、易刺激性、興奮に起因する、過活動又は攻撃的言動> 通常、成人にはブレクスピプラゾールとして1日1回0.5 mgから投与を開始した後、1週間以上の間隔をあけて増量し、1日1回1 mgを経口投与する。なお、忍容性に問題がなく、十分な効果が認められない場合に限り、1日1回2 mgに増量することができるが、増量は1週間以上の間隔をあけて行うこと。 |
*効能又は効果に関連する使用上の注意並びに用法及び用量に関連する使用上の注意は、電子化された添付文書をご覧ください。
【製品写真】

- *1Sano M et al. Agitation in cognitive disorders: Progress in the International Psychogeriatric Association consensus clinical and research definition. Int Psychogeriatr. 2023 Mar 7:1-13.
- *2Halpern R et al. Using electronic health records to estimate the prevalence of agitation in Alzheimer disease/dementia. Int J Geriatr Psychiatry 2019; 34: 420-431
- *3Fillit H et al. Impact of agitation in long-term care residents with dementia in the United States. Int J Geriatr Psychiatry 2021; 36: 1959-1969
- *4CMAI :Cohen-Mansfield Agitation Inventory 攻撃的行動と非攻撃的行動を含む29項目のアジテーション症状の出現頻度を7段階で評価する指標
- *5CGI-S: Clinical Global Impression-Severity Illness 臨床全般印象・重症度スコア






